¿Qué es un átomo?
El átomo
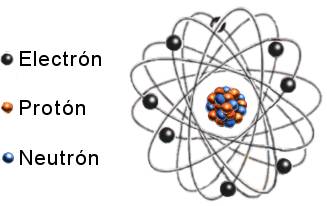
- El átomo es la unidad más simple en que puede dividirse un elemento, reteniendo las propiedades originales del mismo.
- Se compone de dos partes fundamentales: el núcleo y la nube electrónica.
- El núcleo es 10 000 veces más pequeño que el átomo pero concentra el 99% de la masa de éste.
- El núcleo se compone de dos partículas: los neutrones que no poseen carga y los protones, que poseen carga eléctrica positiva.
- La nube de electrones rodea al núcleo. Los electrones poseen carga negativa y, en el átomo neutro, igualan en número a los protones del núcleo.
- La masa del electrón es 1840 veces menor que la del protón. La masa del neutrón es ligeramente superior a la del protón.
- Se denomina ión de un átomo a la partícula cargada que se origina cuando el átomo pierde o gana electrones
Configuración electrónica
Los electrones se agrupan en órbitas o capas, con energía bien definida y que aceptan un determinado número de electrones. Cada capa electrónica corresponde a un nivel de energía permitido. Los electrones pasan de una capa a otra absorbiendo o emitiendo fotones cuya energía es la diferencia entre las energías de los niveles involucrados.Es decir, el electrón -y en general toda partícula incluyendo al átomo- tiene su energía discretizada, no puede tomar cualquier valor. Cada capa se designa con un número de acuerdo al orden decreciente de energía de enlace, o también, mediante letras de la K hasta la Q. La capa K es la más cercana al núcleo, y los electrones pertenecientes a ella poseen la mayor energía de enlace.
Isóbaros
átomos que tiene el mismo A Nucleidos: se llaman así los núcleos con A, Z y un estado energético definidos.Isótonos
Son nucleidos que tienen el mismo NIsómeros
Son nucleidos que tienen el mismo A y el mismo Z pero distinto estado energético.Unidades de masa atómica
u.m.a.: se define como 1/12 de la masa del átomo de C 12 . La masa de cualquier átomo expresada en gramos es igual al peso atómico dividido el Nº de Avogadro (6,02 10 23 átomos).Entonces: 12 g / (6,02 10 23 ) = 1,99 10 -23 g 1u.m.a = 1,99 10 -23 g/12 = 1,66 10 -24 g
Unidades de Energía
Electronvoltio: es la cantidad de energía adquirida por un electrón cuando se acelera en un campo eléctrico producido por una diferencia de potencial de 1volt. Se simboliza eV.- 1 eV = 1,6 10 -19 Joule
- 1 keV = 1 000 eV
- 1 MeV = 1 000 000 eV
Equivalencia masa - energía
En 1905 Einstein da a conocer la Teoría Especial de la Relatividad, en la cual la energía de una partícula está dada por:E = mc 2 + T + V
El primer término es la llamada energía en reposo de la partícula, y establece una equivalencia entre la masa y la energía. C es la velocidad de la luz en el vacío.
Las consecuencias del principio de equivalencia masa - energía son:
- Una cantidad pequeña de materia puede dar lugar a una enorme energía liberada.
- La energía se puede condensar en materia.
- 1 u.m.a = 931 MeV es la equivalencia en unidades.
- La masa de un átomo es menor que la suma de las masas de las partículas que lo componen. Esto se llama defecto de masa.
