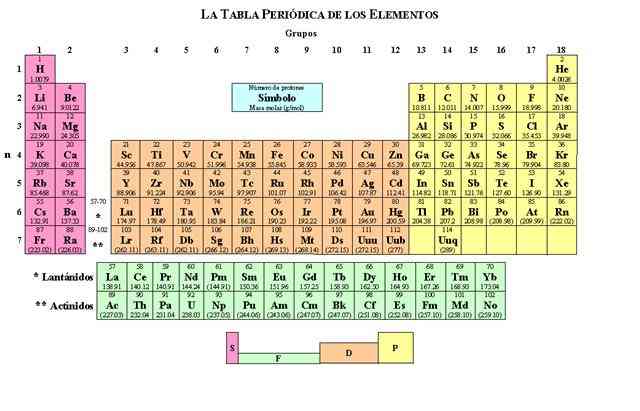
Tabla de los elementos químicos, metales y no metales
Todos los elementos químicos están ordenados por orden creciente de número atómico Z, y en
forma tal que refleja la estructura atómica, en una tabla denominada tabla periódica.
Los elementos están distribuidos en siete hileras horizontales, llamadas períodos, y en 18
columnas verticales, llamadas grupos. El primer período, que contiene dos elementos, el
hidrógeno y el helio, y los dos períodos siguientes, cada uno con ocho elementos, se llaman
períodos cortos. Los períodos restantes, llamados períodos largos, contienen 18 elementos en el
caso de los períodos 4 y 5, ó 32 elementos en el del período 6. El período largo 7 incluye el
grupo de los actínidos, que ha sido completado sintetizando núcleos radiactivos más allá del
elemento 92, el uranio.
El número del período indica la cantidad de capas que posee el átomo del elemento considerado. Así, por ejemplo, el átomo de hidrógeno H que pertenece al período 1, tiene una única capa, el átomo de carbono C tiene 2 capas y el de cromo Cr tiene 4.
Las propiedades físicas y químicas de los elementos tienden a repetirse de forma sistemática conforme aumenta el número atómico Z. Todos los elementos de un grupo presentan una gran semejanza y, por lo general, difieren de los elementos de los demás grupos. El radio atómico aumenta de izquierda a derecha y de arriba hacia abajo, en la tabla periódica, conforme aumenta el número atómico.
La electronegatividad de un elemento es una propiedad que resulta de la estructura de sus átomos. Permite explicar la naturaleza de las uniones químicas y se define como la capacidad del átomo para atraer electrones. En general, la electronegatividad aumenta de izquierda a derecha y disminuye de arriba hacia abajo. Por lo tanto los elementos situados a la derecha de la tabla, a excepción de los gases nobles (grupo 18), son electronegativos y los situados a la izquierda son electropositivos, pues tienden a ceder electrones. A la izquierda se encuentran los metales y a la derecha los no metales.
El número del período indica la cantidad de capas que posee el átomo del elemento considerado. Así, por ejemplo, el átomo de hidrógeno H que pertenece al período 1, tiene una única capa, el átomo de carbono C tiene 2 capas y el de cromo Cr tiene 4.
Las propiedades físicas y químicas de los elementos tienden a repetirse de forma sistemática conforme aumenta el número atómico Z. Todos los elementos de un grupo presentan una gran semejanza y, por lo general, difieren de los elementos de los demás grupos. El radio atómico aumenta de izquierda a derecha y de arriba hacia abajo, en la tabla periódica, conforme aumenta el número atómico.
La electronegatividad de un elemento es una propiedad que resulta de la estructura de sus átomos. Permite explicar la naturaleza de las uniones químicas y se define como la capacidad del átomo para atraer electrones. En general, la electronegatividad aumenta de izquierda a derecha y disminuye de arriba hacia abajo. Por lo tanto los elementos situados a la derecha de la tabla, a excepción de los gases nobles (grupo 18), son electronegativos y los situados a la izquierda son electropositivos, pues tienden a ceder electrones. A la izquierda se encuentran los metales y a la derecha los no metales.
De acuerdo con la Mecánica Cuántica no es posible establecer, en un instante dado, la
velocidad y la posición de un electrón en un átomo. Se habla de probabilidad de hallar a un
electrón en un determinado lugar alrededor del núcleo.
Los electrones están dispuestos en capas o niveles que corresponden a zonas con mayor probabilidad de hallar al electrón. Al aumentar el número de electrones, conforme aumenta el Z, aumenta el número de niveles. Estas capas se denotan con las letras K, L, M, N, O, P, Q, y admiten un número máximo de electrones, dado por la expresión 2n 2 , siendo n el número de capa. Así la K admite 2 electrones, la L 8, la M 18, la N 32.
Se llama orbital atómico a la función matemática ψ que es solución de la Ecuación de Schrödinger, tal que ψ2 da la probabilidad de encontrar un electrón en una zona del espacio alrededor del núcleo. Cada electrón está “caracterizado” por sus 4 números cuánticos:
El n indica el nivel o capa. Como cada capa admite un máximo de electrones, y no puede haber más de 2 electrones en un orbital, se deduce que al aumentar Z aumenta el número de orbitales por cada capa. Los valores que puede tomar n son números enteros: 1, 2, 3, 4, 5, etc.
El l está relacionado con el momento angular del electrón en su movimiento orbital alrededor del núcleo. Puede tomar valores desde 0 hasta (n – 1). Por ejemplo si n = 2, l puede valer 0 ó 1. Cuando l vale 0 el orbital recibe el nombre “s”, cuando vale 1 se llama orbital “p”, cuando vale 2 se llama “d”, cuando vale 3 se llama “f” y así sucesivamente.
Cada uno de éstos orbitales está asociado con una representación de la densidad electrónica en el espacio alrededor del núcleo, relacionada con la probabilidad de encontrar al electrón. El m está relacionado con las posibles orientaciones del vector momento angular en un campo magnético. Puede adoptar valores desde -l hasta +l pasando por el 0. Por ejemplo: –l, 0 , +l. El s (relacionado con el movimiento de rotación del electrón sobre su eje) puede valer +1/2 o – 1/2 según el momento angular de spin tenga un sentido otro.
Los electrones están dispuestos en capas o niveles que corresponden a zonas con mayor probabilidad de hallar al electrón. Al aumentar el número de electrones, conforme aumenta el Z, aumenta el número de niveles. Estas capas se denotan con las letras K, L, M, N, O, P, Q, y admiten un número máximo de electrones, dado por la expresión 2n 2 , siendo n el número de capa. Así la K admite 2 electrones, la L 8, la M 18, la N 32.
Se llama orbital atómico a la función matemática ψ que es solución de la Ecuación de Schrödinger, tal que ψ2 da la probabilidad de encontrar un electrón en una zona del espacio alrededor del núcleo. Cada electrón está “caracterizado” por sus 4 números cuánticos:
- n = nº cuántico principal m = nº cuántico magnético
- l = nº cuántico angular o azimutal s = nº cuántico de spin
El n indica el nivel o capa. Como cada capa admite un máximo de electrones, y no puede haber más de 2 electrones en un orbital, se deduce que al aumentar Z aumenta el número de orbitales por cada capa. Los valores que puede tomar n son números enteros: 1, 2, 3, 4, 5, etc.
El l está relacionado con el momento angular del electrón en su movimiento orbital alrededor del núcleo. Puede tomar valores desde 0 hasta (n – 1). Por ejemplo si n = 2, l puede valer 0 ó 1. Cuando l vale 0 el orbital recibe el nombre “s”, cuando vale 1 se llama orbital “p”, cuando vale 2 se llama “d”, cuando vale 3 se llama “f” y así sucesivamente.
Cada uno de éstos orbitales está asociado con una representación de la densidad electrónica en el espacio alrededor del núcleo, relacionada con la probabilidad de encontrar al electrón. El m está relacionado con las posibles orientaciones del vector momento angular en un campo magnético. Puede adoptar valores desde -l hasta +l pasando por el 0. Por ejemplo: –l, 0 , +l. El s (relacionado con el movimiento de rotación del electrón sobre su eje) puede valer +1/2 o – 1/2 según el momento angular de spin tenga un sentido otro.
